2025年11月Cell期刊精华
来源:生物谷原创 2025-11-28 10:06
2025年11月份即将结束,11月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2025年11月份即将结束,11月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:生病时,大脑和免疫系统如何促进卧床休息
DOI: 10.1016/j.cell.2025.10.040
在整个动物界,当感染来袭时,社交接触便会停止。一项新研究详细揭示了免疫系统与中枢神经系统如何共同实现这种"疾病行为"。当我们对抗感染时,会失去与他人交往的欲望,这完全合乎情理——既能保护他人免受感染,也让我们获得急需的休息。但一直不甚明确的是,这种行为改变是如何发生的。
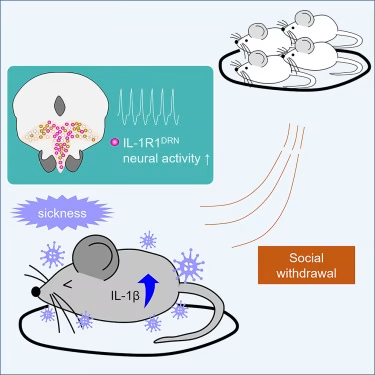
在发表于《细胞》杂志的研究中,麻省理工学院皮考尔学习与记忆研究所的科学家及其合作者运用多种方法证实:当免疫系统细胞因子白细胞介素-1β抵达大脑中缝背核神经元的IL-1R1受体时,会激活与中间外侧隔膜的连接,从而抑制社交行为。
"我们的研究结果表明,免疫激活后的社交隔离是自我施加的,由主动的神经过程驱动,而非疾病生理症状的次要后果,"研究的共同资深作者、皮考尔研究所和麻省理工学院脑与认知科学系副教授Gloria Choi表示。
Choi和Huh的长期合作此前已发现其他细胞因子通过结合大脑中的受体来影响社交行为。因此在这项研究中,他们的团队假设类似的机制可能导致感染期间的社交回避。但具体是哪种细胞因子?又会影响哪些脑回路?
为了着手研究,刘阳和同事们依次向小鼠大脑注射了21种不同的细胞因子,观察是否有任何一种能像给小鼠注射LPS一样引发社交回避。结果发现,只有注射IL-1β能完全重现LPS引发的社交回避行为。不过,IL-1β同时也会让小鼠变得更加倦怠。
DOI: 10.1016/j.cell.2025.10.017
遗传工程师能够设计并组装复杂的基因电路(gene circuit),为细胞编程赋予新功能。然而,随着细胞生长分裂,重要的信号分子可能被稀释,导致合成基因电路丧失其新功能。
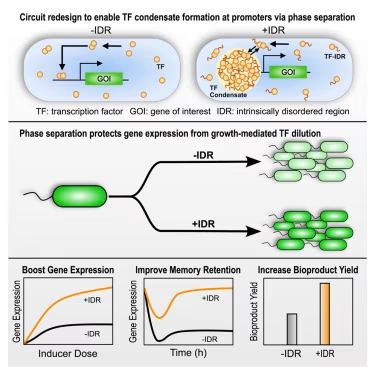
亚利桑那州立大学(ASU)工程学院的生物与健康系统工程学院的副教授Tian晓军及其团队发现了一种方法,可直接借鉴自然界的原理来保护这些脆弱的遗传程序。该项目汇聚了合成生物学、建模与代谢工程领域的跨学科专业知识。研究团队包括富尔顿工程学院物质、运输与能源工程学院的化学工程教授 David Nielsen,以及同为 ASU 富尔顿工程学院应用科学与艺术学院的化学副教授Wenwei Zheng。
在一篇发表于《细胞》杂志的新论文中,研究人员概述了一种技术,该技术可通过称为"液-液相分离"的过程在细胞内形成微小的液滴状区室,从而稳定合成基因电路。这些被称为"转录凝聚体(transcriptional condensates’)"的微观液滴,如同围绕关键基因的"分子安全区",保护着合成工程改造的部件,使其免于在细胞生长的浪潮中被"冲淡"。
"当我们尝试对细胞进行编程以执行有用任务时,例如诊断或治疗性生产,遗传程序常常会失败,因为细胞生长稀释了维持程序运行所需的关键分子,"Xiaojun Tian说。"我们通过利用细胞自身的相分离策略来保护工程系统,从而应对了这一挑战。"
3.Cell:新研究绘制出活细胞中DNA折叠的单碱基对分辨率图谱
DOI: 10.1016/j.cell.2025.10.013
牛津大学拉德克利夫医学系的科学家们成功实现了对活细胞内DNA折叠及功能运作的最精细观测,揭示了控制基因在何时、以何种方式被激活的物理结构。
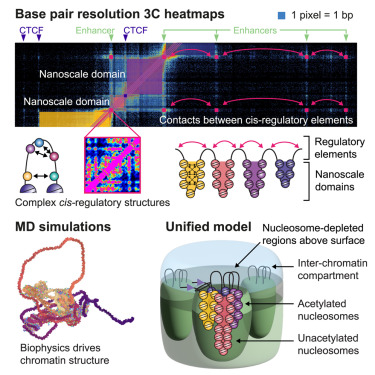
研究团队采用名为MCC ultra的新技术,将人类基因组图谱绘制精度提升至单个碱基对水平,从而揭示了基因是如何被调控的,即身体如何在正确的细胞、正确的时间决定开启或关闭哪些基因。这一突破为科学家理解遗传差异如何导致疾病提供了强大的新方法,并为药物发现开辟了新途径。
"我们首次能够看到基因组控制开关在细胞内部的物理排布方式,"该研究论文的领衔作者James Davies教授表示。该研究发表于《细胞》杂志。"这改变了我们对基因工作机制以及疾病中出错环节的理解。我们现在能够看到DNA复杂结构的变化如何导致心脏病、自身免疫性疾病和癌症等病症。"
4.隐形 CRISPR 横空出世!Cell:免疫健全模型解锁癌症转移新靶点,AMH-AMHR2 轴成抗癌新希望
DOI: 10.1016/j.cell.2025.10.007
免疫系统是对抗肿瘤转移的关键力量,因此在免疫功能完整的模型中研究癌症,才能真正还原患者体内的疾病进程——但这一目标长期被 CRISPR/Cas9 技术的固有缺陷所阻碍。借助 CRISPR/Cas9,科学家能构建包含数百个基因敲除肿瘤细胞的文库,移植到小鼠体内后,即可快速筛选影响癌症发展的关键基因,为新疗法开发提供核心靶点。
然而,CRISPR/Cas9 的核心组分(如 Cas9 核酸酶)源自细菌,会被免疫系统识别为 “外来入侵者”,引发强烈免疫反应,这一问题一直被忽视。
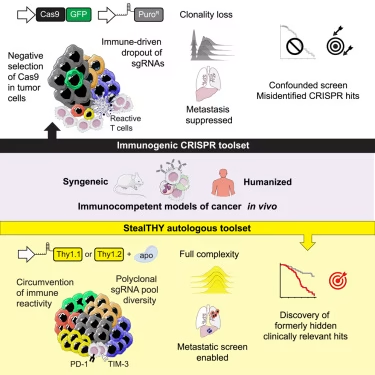
苏黎世联邦理工学院 Nicola Aceto 教授团队在《细胞》杂志发表的研究,首次详细证实了这种免疫反应会严重扭曲筛选结果,并创新性地开发出 StealTHY 平台——给 CRISPR 披上 “分子隐形斗篷”,使其在免疫健全小鼠乃至人源化小鼠中 “隐身” 工作,成功解锁了被掩盖的癌症转移关键靶点。
StealTHY 平台的 “隐形术” 核心在于三点创新,彻底规避免疫识别。首先是 “瞬时编辑+快速清除”:团队采用脱辅基 Cas9(Apo-Cas9)进行瞬时递送,Cas9 在完成基因编辑后 48 小时内即被细胞清除,避免长期停留引发免疫反应;同时通过 “hara-kiri” 自靶向系统,快速分离出基因编辑成功的细胞,确保移植到小鼠体内的肿瘤细胞不含任何细菌来源组分。其次是 “自体报告基因替代”:用小鼠自身蛋白 Thy1 的两种亚型(Thy1.1/Thy1.2)替代 GFP 和 PuroR,这种自体蛋白不会引发免疫排斥,还能精准追踪肿瘤细胞。最后是 “全人源适配”:在人源化小鼠中,团队将人类 THY1 基因改造后作为报告基因,同样实现了免疫隐身。这套 “hit-and-run” 编辑策略,让 CRISPR 筛选首次在免疫健全模型中保持了 sgRNA 文库的完整性,克隆多样性比传统方法高 5 倍以上。
5.Cell:新研究揭示蛋白中的固有无序区域及其在癌症中的作用
DOI: 10.1016/j.cell.2025.10.019
细胞中的每个功能都与特定的蛋白质或蛋白质组相关联,通常具有明确的三维结构。然而,蛋白质的固有无序区域却打破了这种结构-功能范式。
圣路易斯华盛顿大学麦凯维工程学院的一个研究团队开发出一种算法,用于理解蛋白质中的固有无序区域如何被组织成不同的功能类别。这一研究工具可极大增进对某些癌症增殖机制的理解。
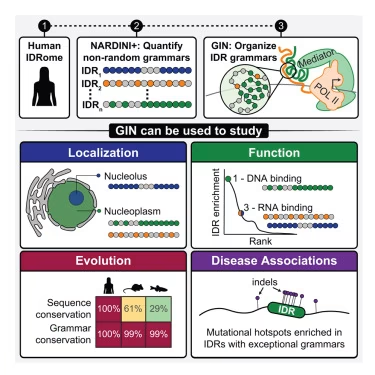
该学院生物医学工程系的Gene K. Beare杰出教授Rohit V. Pappu实验室的研究人员Kiersten Ruff和博士后研究员Matthew King,利用Pappu实验室先前开发的NARDINI+算法,分析了蛋白质固有无序区域(intrinsically disordered regions, IDRs)的氨基酸序列,以揭示并组织所谓的"分子语法"。
通过使用无监督学习来检测非随机的氨基酸使用模式以及线性序列中氨基酸的非随机排列,Ruff发现天然序列的语法可归入有限数量的簇中,每个簇都具有一组特定的功能。这项工作促使他们创建了一个名为GIN的资源。该研究成果发表于《细胞》杂志。
6.Cell:新研究发现AML细胞的代谢弱点,有望开发出阻止AML复发的新疗法
DOI: 10.1016/j.cell.2025.10.028
彼得麦克研究所的研究人员发现了一种杀死急性髓系白血病(acute myeloid leukemia, AML)癌细胞的新方法。该研究发表于《细胞》杂志。
研究团队发现,AML细胞——尤其是驱动复发的干细胞依赖一种名为"血红素(heme)"的常见分子来生存并持续增殖。当这一过程被阻断时,癌细胞会通过一种新发现的细胞死亡形式"铜死亡机制"而死亡。
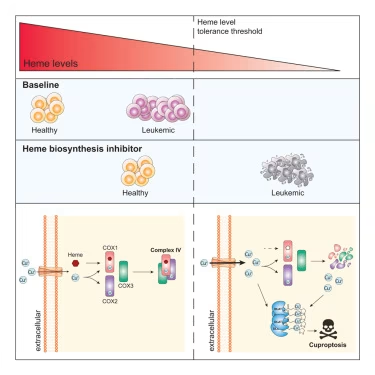
"我们揭示了AML细胞的一个根本弱点,"彼得麦克博士后研究员Alexander Lewis博士表示。"通过阻止AML细胞产生血红素,我们可以激活铜死亡机制,这是一种独特的细胞死亡形式,能有效杀死那些最可能导致癌症复发的细胞。这为开发潜在更强大、更持久的疗法打开了大门。"
DOI: 10.1016/j.cell.2025.10.030
利用人体自身免疫系统对抗癌症的免疫疗法,已经彻底改变了现代肿瘤学的格局。然而,尽管它在多种癌症中取得了成功,许多患者仍然对治疗没有反应或在后期出现复发。科学家们长期致力于精确定位癌症如何关闭免疫应答,并希望在病灶原位重新激活免疫系统。
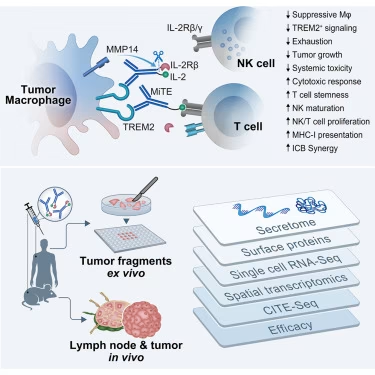
魏茨曼科学研究所今日发表于《细胞》杂志的一项新研究表明,解决方案可能在于肿瘤自身的防御系统之内。该研究聚焦于巨噬细胞——这是一种大型、多功能的细胞,在身体各组织中执行重要功能,但当它们存在于肿瘤微环境中时,常常开始与癌症"同流合污"。
"多年来我们已知,在癌症中,巨噬细胞既可以是问题的一部分,也可以是解决方案的一部分,"魏茨曼研究所免疫治疗研究中心主任Ido Amit教授说。"肿瘤会劫持它们以抑制免疫应答并促进自身生长。我们的目标一直是重新'教育'这些细胞,而不是清除它们。"
在早期的研究中,Amit的团队及其他研究人员已经鉴定出一个尤其参与抑制抗癌免疫反应的巨噬细胞亚群:肿瘤相关巨噬细胞,这些巨噬细胞已转变为肿瘤的"盟友"。它们的标志性特征是异常高表达一种名为TREM2的受体,该受体协调了它们的抗免疫活性。那些肿瘤与这类巨噬细胞"勾结"的患者,通常治疗效果不佳,生存率也较低。
DOI: 10.1016/j.cell.2025.10.006
范德比尔特大学医学中心研究人员领导的一项多机构研究表明,人工智能(AI)和"蛋白质语言"模型能够加速单克隆抗体的设计,这些抗体可用于预防或减轻潜在威胁生命的病毒感染严重程度。
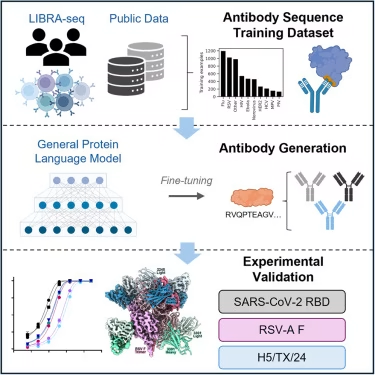
该报告发表在《细胞》杂志上。论文的通讯作者Ivelin Georgiev博士表示,虽然报告重点针对包括RSV和禽流感病毒在内的现有及新发病毒威胁开发抗体疗法,但这项研究的意义远不止于此。
"这项研究是我们实现终极目标——利用计算机高效设计新型生物制剂并从零开始将其转化为临床应用——的重要早期里程碑,"病理学、微生物学和免疫学教授,范德比尔特计算微生物学与免疫学项目主任Georgiev说。"这种方法将对公共卫生产生显著的积极影响,并可应用于广泛的疾病领域,包括癌症、自身免疫性疾病、神经系统疾病等许多其他疾病,"他表示。
DOI: 10.1016/j.cell.2025.10.038
我们的肠道微生物组由数万亿生活在肠道内的细菌和其他微生物组成。它们帮助身体分解食物、协助免疫系统、向大脑发送化学信号,并可能具有许多研究人员仍在努力了解的功能。当微生物组失衡时,会影响我们的整个身体。
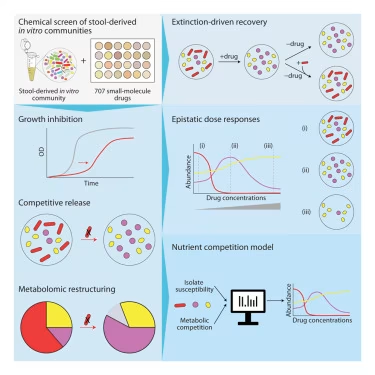
许多研究人员已经意识到抗生素会破坏肠道微生物组,但较少被认识到的是,其他药物也能重塑这个微生物群落。在11月17日发表于《细胞》杂志的一项研究中,斯坦福大学的研究人员深入探究了多种常见药物如何影响肠道中数万亿的微生物,以及这对代谢、免疫反应和整体健康可能产生的深远影响。
研究表明,肠道微生物组的许多变化是由对营养物质的竞争驱动的——药物减少了某些细菌种群,改变了营养物质的可用性,而最能够利用这些变化的细菌得以生存。
"这项工作揭示了药物引起的微生物组紊乱遵循可预测的生态学规律,这为预测甚至预防对肠道健康的副作用打开了大门,"该论文的资深作者、斯坦福大学工程学院和医学院的教授、微生物学和免疫学教授KC Huang说。"这对药物设计、个性化医疗和微生物组的恢复力具有重要意义。"
DOI: 10.1016/j.cell.2025.07.022
多伦多大学研究人员领导的一项新研究表明,肠道免疫细胞通过一种非典型途径产生抗体,从而提供针对病毒的长期保护。这项发表于《细胞》杂志的研究结果,可能有助于指导开发针对流感、SARS-CoV-2和禽流感等呼吸道病毒的更有效疫苗。
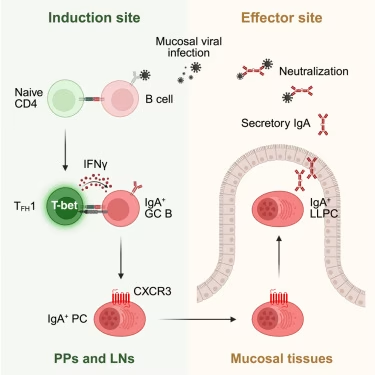
虽然COVID-19和流感疫苗能降低重症风险,但在预防感染发生方面效果较差。要预防感染,疫苗必须在病毒通常入侵的部位——鼻子、口腔和气道——激活强烈的免疫反应。这种所谓的黏膜免疫依赖于一种名为IgA的抗体,该抗体集中分布于呼吸道和消化道的内壁黏膜中,并通过唾液和眼泪等体液分泌。
"如果你能产生持久的黏膜免疫反应,那就是'圣杯',因为这样你就阻断了病毒的进入,"该研究的资深作者、多伦多大学Temerty医学院免疫学教授兼系主任Jen Gommerman说。"如果你阻断了病毒进入,那么你就不会被感染,也不会传播病毒。"(生物谷Bioon.com)
更多精彩阅读:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


